Unser Unternehmen
Führend in RNAi
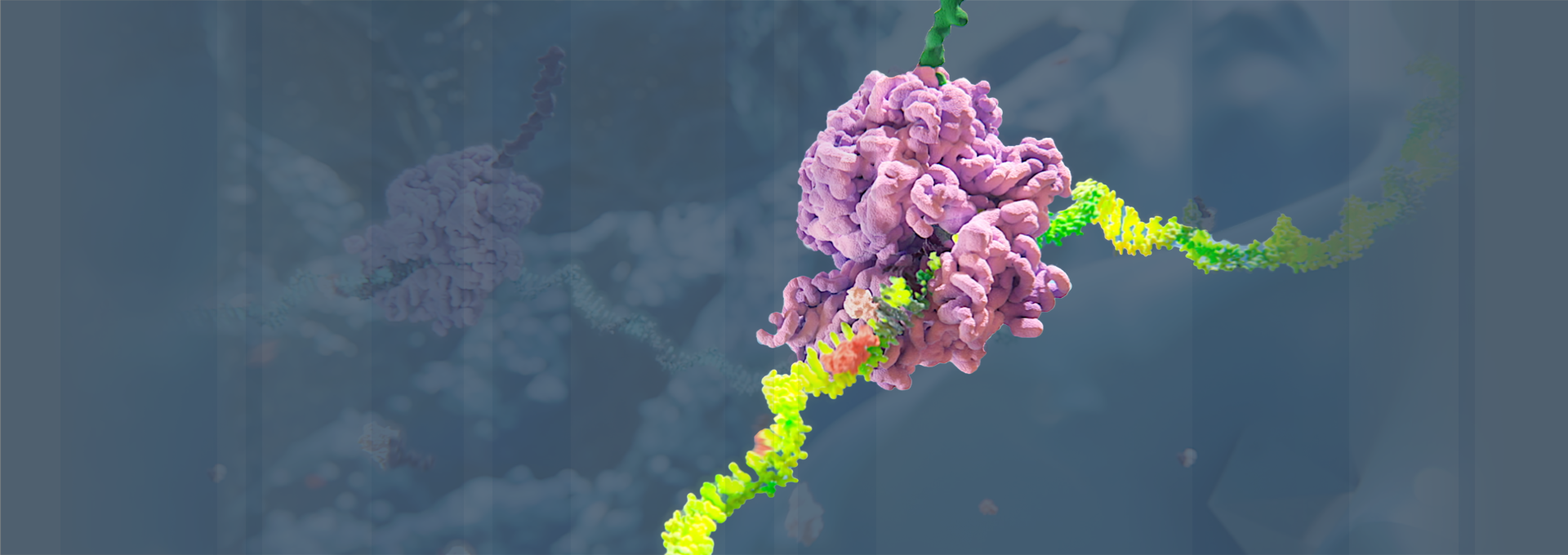
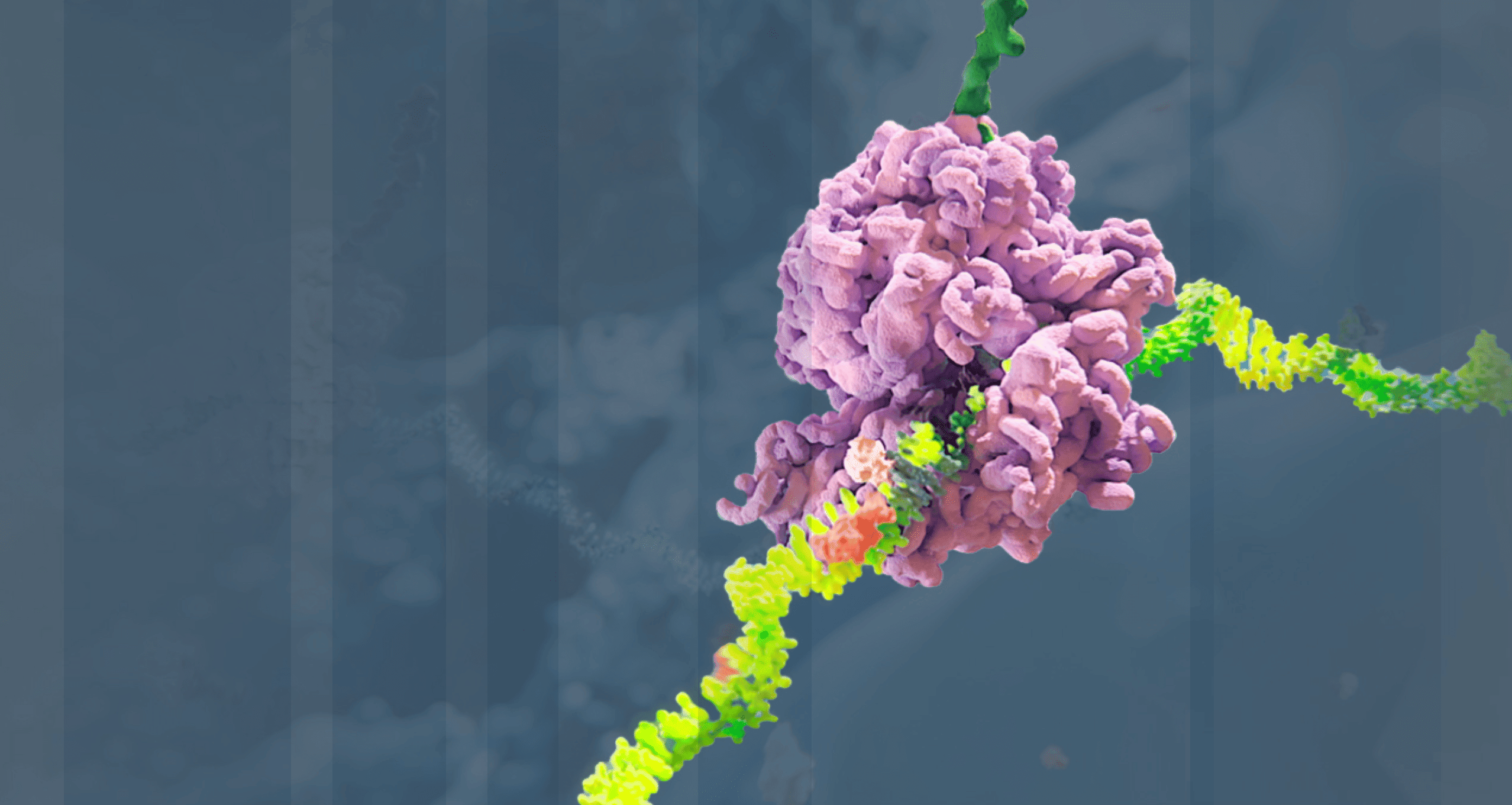
Alnylam hat die RNA-Interferenz (RNAi) von einer Nobelpreis-gekrönten Entdeckung zu einer innovativen Arzneimittelklasse weiterentwickelt, mit der Überzeugung, dass RNAi das Potenzial hat, Menschen auf der ganzen Welt zu einem längeren, gesünderen und erfüllteren Leben zu verhelfen. Durch wegweisende Forschungsarbeiten, unermüdliches Engagement für Patient:innen und die zugelassenen Therapien sowie die umfangreiche Pipeline von RNAi-Therapeutika in der Erforschung, hat Alnylam die Position als innovatives und führendes Unternehmen im Bereich RNAi gefestigt.
UNSERE FORSCHUNGSARBEIT VERÄNDERT DIE ART UND WEISE, WIE ERKRANKUNGEN MEDIKAMENTÖS BEHANDELT WERDEN
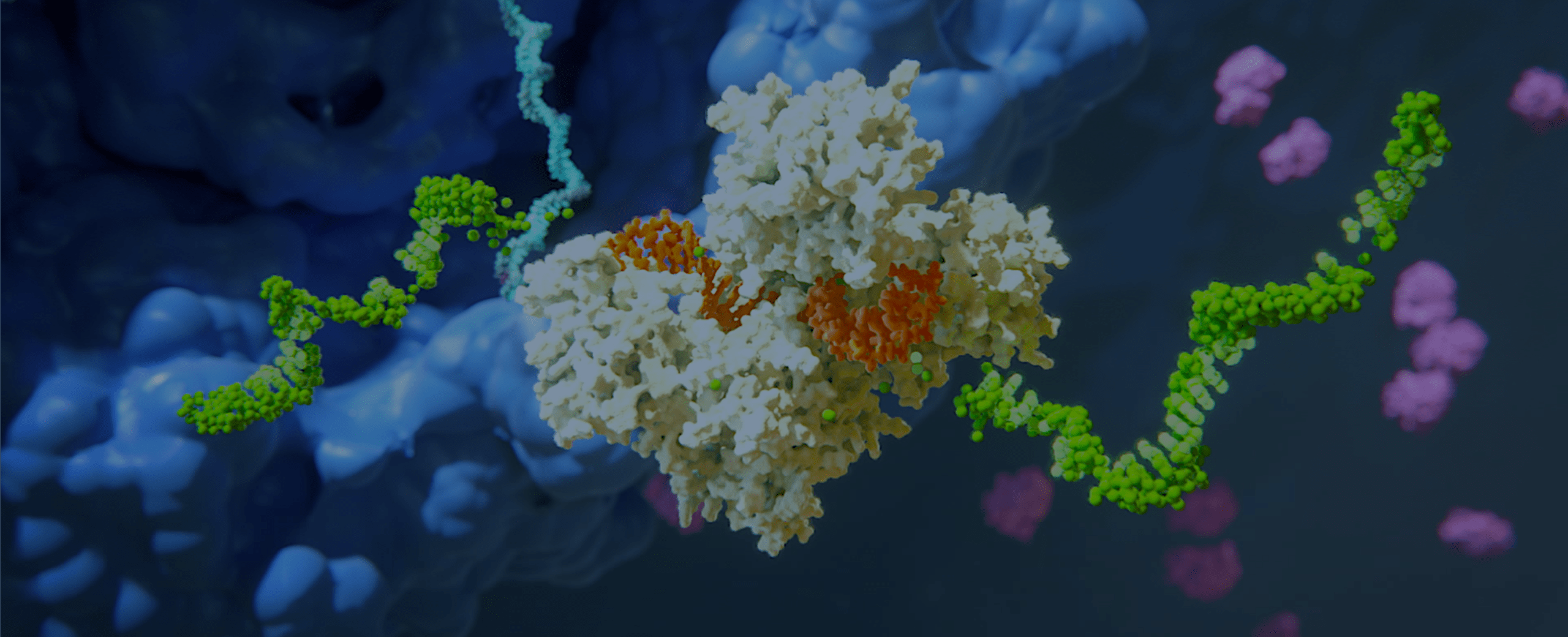
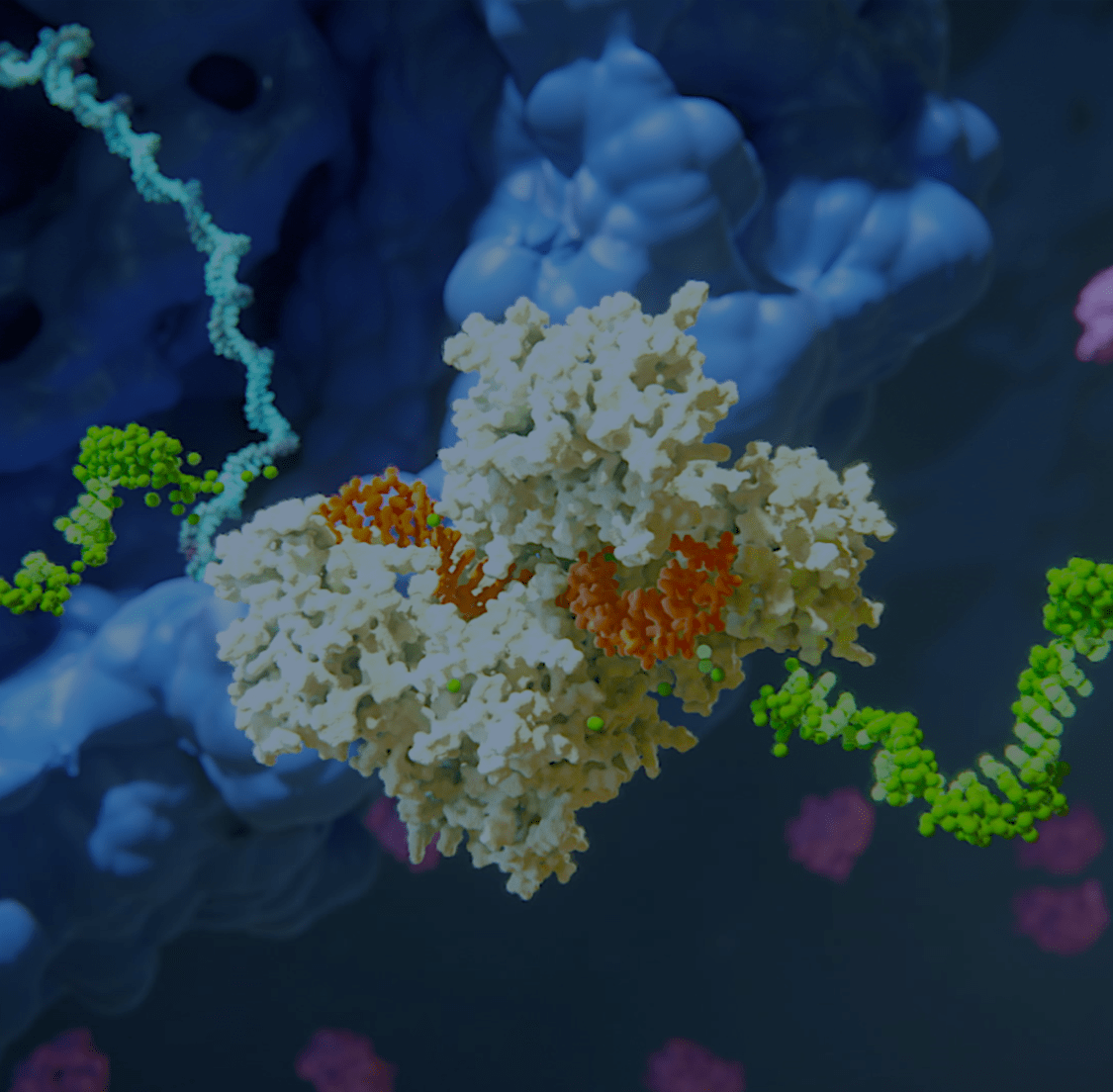
Unsere Wissenschaft
UNSERE PIPELINE
Unsere umfassende Pipeline von RNAi-Therapeutika fokussiert sich auf Erkrankungen mit ungedecktem medizinischen Bedarf und umfasst vier Therapiebereiche: genetische Erkrankungen, Herz- und Stoffwechselerkrankungen, Infektionskrankheiten und Erkrankungen des zentralen Nervensystems (ZNS) und der Augen. Wir haben mehr als ein Dutzend RNAi-Therapeutika in klinischer Entwicklung, davon mehrere in einer späten Entwicklungsphase.
Genetische Erkrankungen
Herz- und Stoffwechsel- erkrankungen
Infektionskrankheiten
Erkrankungen des zentralen Nervensystems und der Augen

Karriere
SCHLIESSEN SIE SICH UNS AN
Wir sind über 2.000 engagierte, leidenschaftliche Personen, die "die Welt verändern" wollen und fest an die Kraft und das Potenzial unserer Technologie und an das, was wir als Unternehmen aufbauen, glauben. Wenn Sie auf der Suche nach einer Mission sind, auf der Suche nach Kolleg:innen, die Sie inspirieren, nach einem Unternehmen, das sowohl den Beitrag der Gruppe als auch den des Einzelnen anerkennt und belohnt, dann ist dies vielleicht Ihr Moment, sich uns anzuschließen.